
黄精因其优异的生物活性而被广泛应用。本研究以黄精为原料制备了一种新的黄精多糖。通过单糖组成分析,PSP主要由果糖和葡萄糖组成,摩尔比为93.81:5.12。鉴定出主要的连锁类型为α-D-Glcp1→和→2-β-D-Fruf-1→。模拟唾液和胃肠消化后,PSP分子量无明显变化。然而,PSP可以被肠道细菌分解。我们的研究结果表明,PSP管理增加了益生菌如双歧杆菌的丰度。此外,肠道微生物可以利用PSP产生短链脂肪酸,包括乙酸、丙酸和丁酸。PSP发酵液对DPPH、超氧自由基、羟基自由基等自由基均有较好的清除作用。综上所述,本研究将有助于促进PSP作为益生元在功能食品和医疗行业的应用。
1. 介绍
益生元是一种不可消化的成分,通过肠道微生物的代谢调节肠道菌群的组成或活性,从而对宿主产生有益的生理作用。近年来,植物多糖的益生元潜力受到广泛关注,主要包括菊粉、低聚果糖、阿拉伯木聚糖和各种膳食纤维。益生元可特异性促进肠道益生菌如乳杆菌、双歧杆菌的生长。这些来自植物的益生元可以被结肠内的肠道菌群发酵,细菌将多糖分解成低聚糖、短链脂肪(SCFAs)等产物,有助于宿主的健康。黄精属百合科,作为一种具有药用和食用双重用途的植物,具有丰富的食物用途。而且,根茎在日常生活中,它也被用来制作草药酒或煮成茶的替代品。在一些地区,人们将黄精根茎作为添加剂添加到蛋糕或调味料中。此外,还能刺激唾液和胃液分泌,保护呼吸系统,促进食欲,增强免疫力。木犀草主要由甾体皂苷、类黄酮[8]、生物碱[9]、木脂素、氨基酸、多糖等组成。尤其是主成分,即黄精(Polygonatum sibiricum polysaccharides, PSP),据报道具有降血糖、抗癌、抗氧化、抗炎和抗骨质疏松等作用。
通常,多糖经胃肠道消化后,其化学结构、分子量和生物活性都会发生显著变化。例如,胃肠道内消化酶和pH值的变化可能会影响多糖摄入后的理化性质。然而,对于那些具有益生元作用的多糖,它们在上消化道是无法消化的,如Gracilaria rubra polysaccharides (GRPS)和Lycium barbarum polysaccharides (LBPS)。到目前为止,宿主分泌的消化酶是否能分解肠道内的PSP尚不清楚。……,PSP在胃肠道中的消化特性及其对宿主肠道菌群组成的影响仍有待进一步研究。
本研究旨在探讨PSP在体外唾液-胃肠消化和随后的人体粪便发酵过程中理化性质的变化。采用水提醇沉法制备了PSP,并对其理化性质进行了研究。接下来,我们研究了模拟唾液-胃肠消化过程中PSP的动态特性。通过体外发酵模型,探讨PSP对人体肠道菌群发酵及其代谢物(SCFAs)产生的影响。并对PSP发酵产物的抗氧化活性进行了研究。
2、研究结果
1)PSP的物理化学性质
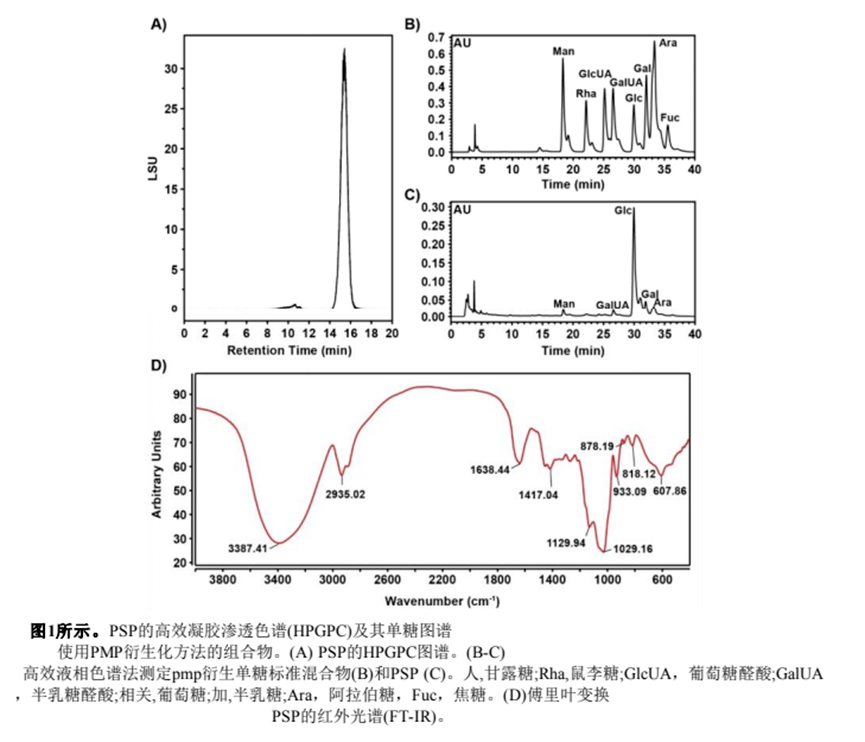
我们分析了PSP的理化性质,结果表明,PSP的总碳水化合物含量丰富,还原糖、蛋白质和醛酸含量低。PSP的色谱图显示为一个对称的单峰,从分子量分布来看,它是均匀的。HPGPC法测定PSP分子量为3.06 kDa。由于PMP衍生化法对果糖结构造成破坏,因此在PSP的HPLC色谱图中没有出现果糖峰。间苯二酚法测定PSP中果糖含量为93.81%。PSP的剩余单糖组成如图1C所示,包含葡萄糖(5.12%)、甘露糖(0.15%)、半乳糖(0.5%)、阿拉伯糖(0.21%)和半乳糖醛酸(0.21%)。这些数据表明PSP是一种以果糖为主要单糖的杂多糖。

2 )PSP的FT-IR光谱分析
从图1D PSP的FT-IR光谱可以看出,3387.41 cm1处的强烈吸收峰主要是O - H的拉伸振动引起的,2935.02 cm-1处是C - H的吸收峰,两者都是多糖的特征吸收峰。在1638.44 cm-1、1417.04 cm-1、1129.94 cm-1和1029.16 cm-1处的吸收峰分别归属于C=O、COOH、C * * * OH、C * * * * * * C的拉伸振动,提示糖醛酸和吡喃环的存在(图1D)。878.19 cm-1处的吸收峰归属于α型糖苷键。此外,933.09 cm-1和818.12 cm-1处的吸收峰归属于具有β型糖苷键的呋喃糖环(图1D)。
3) 甲基化法测定PSP糖渣
为了确定PSP中糖苷键的类型,我们用GC-MS对PSP的部分甲基化糖醇乙酸酯(PMAAs)进行了甲基化分析。结果表明,PSP衍生物含有两个PMAAs(补充图1A)。PSP总离子色谱(TIC)的峰1被鉴定为Terminal-D-glucopyranosyl(补充图1B和补充表1)。甲基化分析中果糖的糖苷键类型尚不清楚,将结合NMR分析推断。
4 )PSP的核磁共振(NMR)分析
利用一维和二维NMR谱分析了PSP的结构。PSP的1H NMR谱如图2A所示。由于酮糖没有端粒质子,因此在端粒质子区只出现δ 5.43 ppm的单一信号,该信号被分配给α- d -葡萄糖醛酸残基的H-1。大部分质子信号集中在δ 3.4±4.4 ppm。结果表明,PSP中既有α-构型(δ > 5.0 ppm),也有β构型(δ < 5.0 ppm),且以β-构型为主Z.H. Qi et al. / Food Science and Human Wellness 13 (2024)FT-IR分析(图1D)。在13C NMR谱(图2B)中,大多数碳信号来自δ 60±110 ppm区域。在δ 103.6 ppm的端粒碳区观察到的信号被分配到果糖残留物的典型峰(C-2)。根据1H1H COSY和HSQC光谱(图2C和2D)对果糖残基的氢信号进行分配。13C NMR谱(图2B)中δ 60.43 ppm、δ 76.72 ppm、δ74.33 ppm、δ 81.06 ppm和δ 62.24 ppm的碳信号分别对应果糖残基的C-1、C-3、C-4、C-5和C-6。此外,葡萄糖残基的碳信号较弱,在13C NMR谱中未被识别,这与PSP中葡萄糖含量较低一致(表1)。最后,糖残基的1H和13C化学位移信号总结如表2所示。
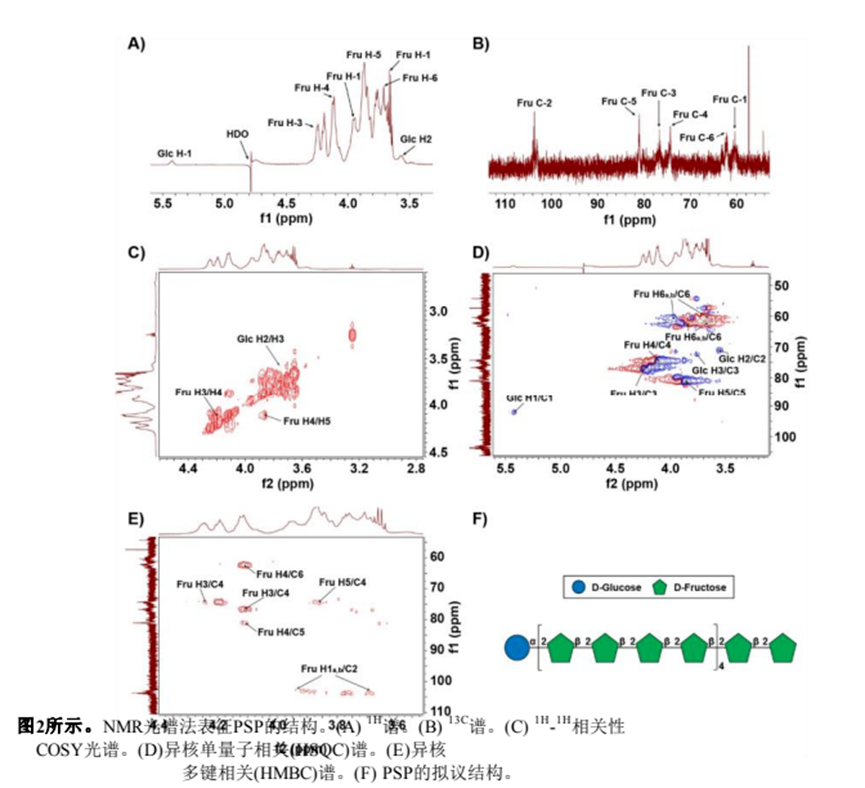
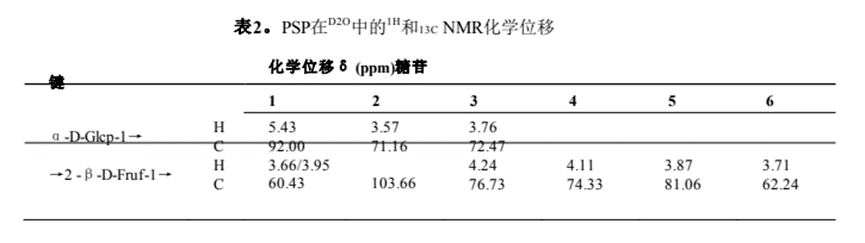
通过HMBC光谱中的相关峰确定PSP中糖残基的序列和连锁位点(图2E)。果糖残基氢信号H-1 (δ 3.66, 3.95 ppm)和碳信号C-2 (δ 103.66 ppm)有相关的信号峰,表明PSP中存在→2)-β- d - fruf -(1→2)-β- d - fruf -(1→2)链。通过甲基化分析和已报道的葡萄糖残基NMR谱[25,26],我们推测葡萄糖残基的键合形式为α-D-Glcp-(1→2)-β- d - fruf -(1→)。综合分析单糖组成、FT-IR和NMR信息分析,我们提出了PSP的预测结构,如图2F和补充图2所示。
5) 模拟PSP体外消化
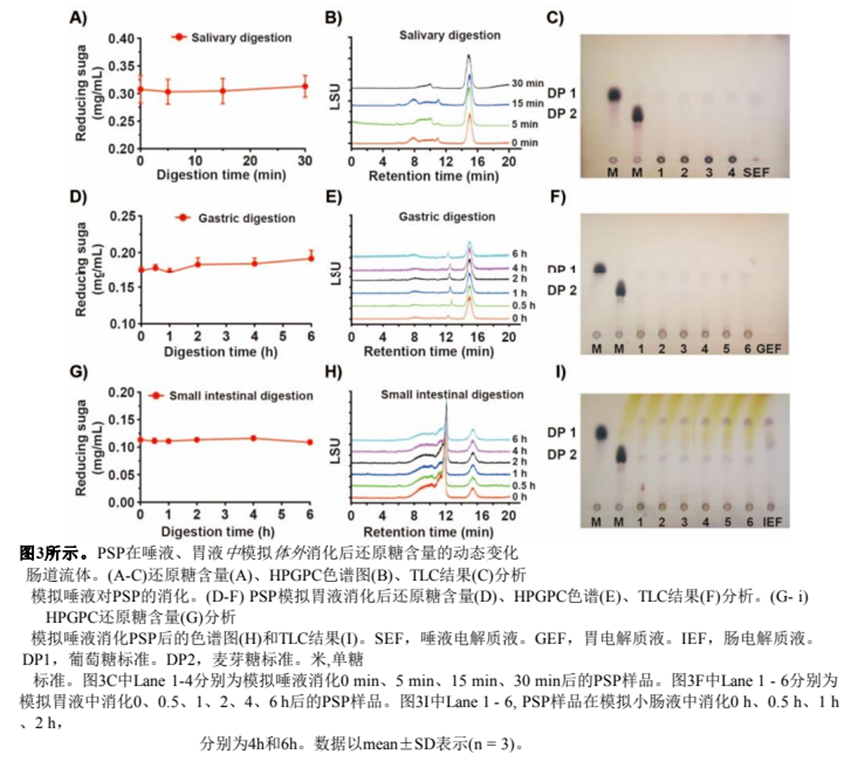
口腔作为食物摄入后的第一个消化部位,分泌α-淀粉酶,催化α-1,4糖苷键的水解[27]。为了观察唾液是否能够分解PSP,我们将PSP与模拟唾液溶液孵育0- 30min。如图3A所示,整个消化过程中,消化液中的还原糖含量保持在0.31 mg/mL。同时,不同时间消化后PSP的HPGPC谱没有变化(图3B)。TLC结果也是如此,表明唾液消化PSP没有产生新的产物(图3C)。总之,我们认为唾液不能消化PSP,这意味着PSP中的糖苷键不能被α-淀粉酶水解。在口腔中初始消化后,食物会通过食道转运到胃中进行后续消化。因此,我们将唾液消化的PSP溶液与模拟胃液孵育。如图3D-F所示,在整个消化过程中,PSP的还原糖含量、HPGPC图谱和TLC结果没有发生变化。综上所述,PSP在酸性条件下(pH 3.0)的胃液中没有被分解。小肠是营养物质消化和吸收的主要部位,因此我们研究了小肠液是否可以分解PSP。如图3G和3H所示,胃液消化PSP溶液与模拟小肠消化液孵育不同时间后,PSP的还原糖含量和HPGPC色谱均未见明显变化。值得注意的是,TLC结果显示,小肠液消化PSP后产生少量单糖。
6) PSP的体外发酵
考虑到肠道菌群可以通过糖苷水解酶代谢饲粮中的多糖[3,19],我们下一步研究了人类肠道菌群对PSP的发酵。
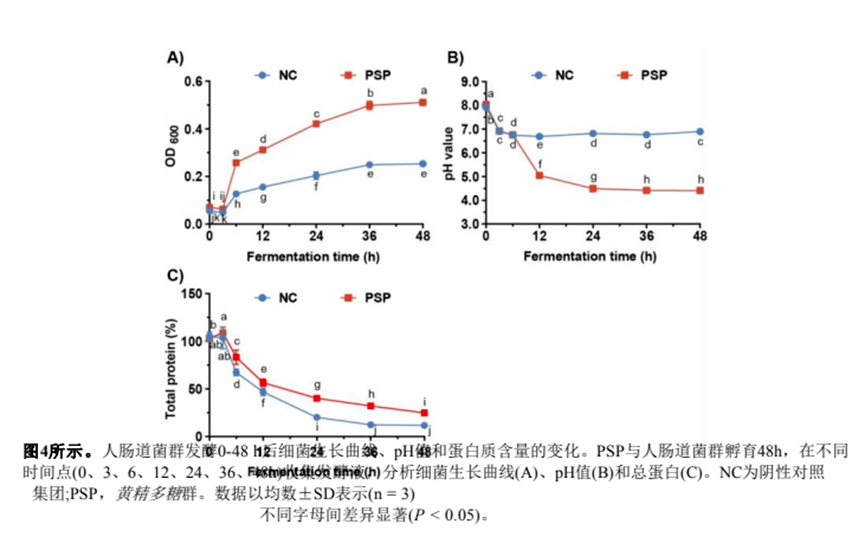
(6.1) PSP发酵液细菌生长曲线、pH值及蛋白质含量分析
我们首先检测了发酵液中肠道菌群的生长曲线。如图4A所示,阴性对照(NC)组的吸光度值(OD600)在3 h时迅速上升,然后在36 h时达到生长平台,吸光度值增加到0.25。与NC组相比,PSP组的OD600在36 h达到0.49,在48 h继续上升到0.51(图4A)。发酵6 h后,PSP组发酵液的OD600始终高于NC组。
细菌在代谢多糖时会产生酸性代谢物(如SCFAs和乳酸),导致肠道pH值降低,肠道菌群结构改变。结果如图4B所示表明,NC组发酵6 h后pH值降至6.7,并在后续发酵过程中保持稳定。相比之下,PSP组在发酵过程中pH值显著降低,在48 h时降至4.4(图4)。
此外,我们检测了发酵液中的总蛋白含量,在NC或PSP组的发酵过程中,总蛋白含量呈下降趋势(图4)。发酵48 h后,PSP组蛋白质含量为24.9%,NC组蛋白质含量为11.7%。
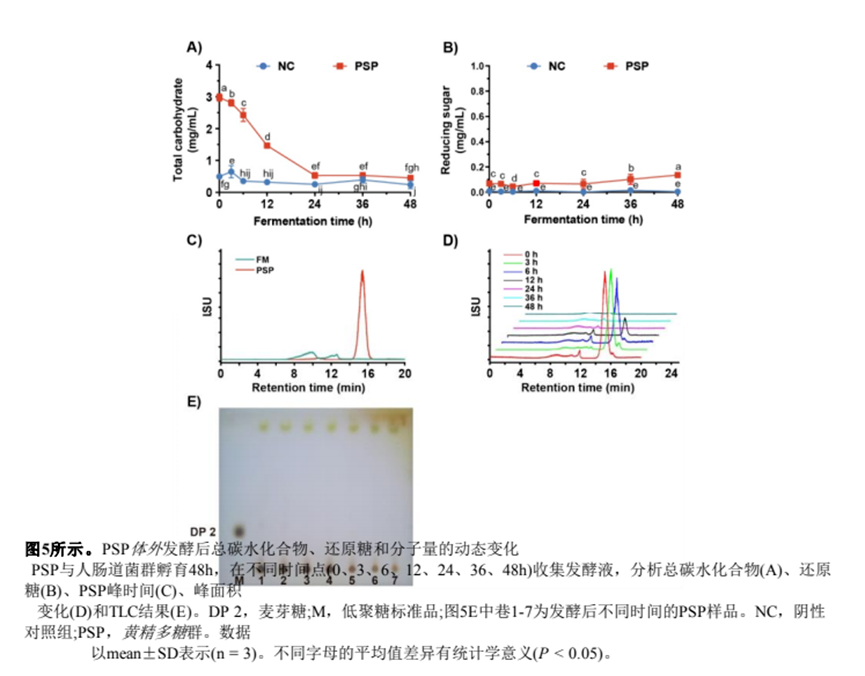
(6.2) 总碳水化合物、还原糖和分子量的动态变化
进一步,我们测试了发酵液中总碳水化合物的动态变化。对于PSP组,发酵324 h后总碳水化合物迅速下降,最终在48 h时降至0.45 mg/mL(图5A)。同时,发酵过程中总碳水化合物的84.9%被肠道菌群利用。
由于来自肠道菌群的糖苷酶可以破坏多糖的糖苷键,从而增加还原糖的产生[29],我们比较了两个实验组发酵液中还原糖含量的差异。如图5B所示,在整个发酵过程中,NC组的糖含量没有明显变化。相比之下,PSP组的还原糖含量在48 h时增加到0.14 mg/mL(图5)。
由于发酵液的复杂性,NC组的峰值出现在812 min,而PSP的峰值出现在15.3 min(图5C)。同时,我们用HPGPC分析了发酵液中不同时间点的PSP(图5D)。结果表明,PSP峰面积随浓度的增加而逐渐减小发酵时间。发酵24 h后,HPGPC谱显示PSP的残留量极低,表明PSP被肠道菌群分解。此外,TLC结果证实发酵液中总碳水化合物在发酵过程中明显减少(图5)。
7 )PSP对肠道菌群组成的影响
为了评估PSP的益生元潜力,我们通过16S rDNA测序评估了PSP对体外肠道微生物群的影响。利用Chao 1和PD全树指数进行α-多样性分析,PSP增强了肠道微生物群落的多样性(图6)。通过主成分分析(PCA)和非度量多维标度(NMDS)的β-多样性评估,将肠道菌群样本划分为三个不同的分类群,表明实验组之间肠道菌群分化良好(图6)。

为了研究PSP对特定肠道菌群的调节作用,我们分析了各组肠道菌群的相对丰度变化。在门水平上,各组肠道菌群主要由厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria)组成,约占细菌群落总数的95%(图7A)。与NC组相比,PSP显著提高了变形菌门和放线菌门的比例(P < 0.05)(图7A)。在科水平上,PSP增加了Veillonellaceae、Enterobacteriaceae和Alcaligenaceae的丰度(P < 0.05,与NC组相比)。相比之下,PSP降低了Bacteroidaceae和Clostridiaceae的含量(P < 0.05,与NC组相比)(图7)。
接下来,我们在属水平上比较了NC组和PSP组肠道菌群的相对丰度差异。如图7C所示,通过分层聚类热图分析了23个最易变的细菌属。与NC组相比,PSP组增加了部分细菌的丰度(如苏特菌和双歧杆菌),减少了部分细菌的丰度(如拟杆菌和拟杆菌)(P < 0.05)。发酵48 h后,NC组的核心微生物为拟杆菌(Bacteroides)(29.7%)、拟杆菌(A listipes)(3.15%)和乳球菌(Lactococcus)(3.09%)(补充图3)。PSP组以拟杆菌(Bacteroides)(17.2%)、微孔菌(Veillonella)(6.98%)、克雷伯菌(Klebsiella)(2.35%)和苏特菌(Sutterella)(3.21%)为主(补充图3)。

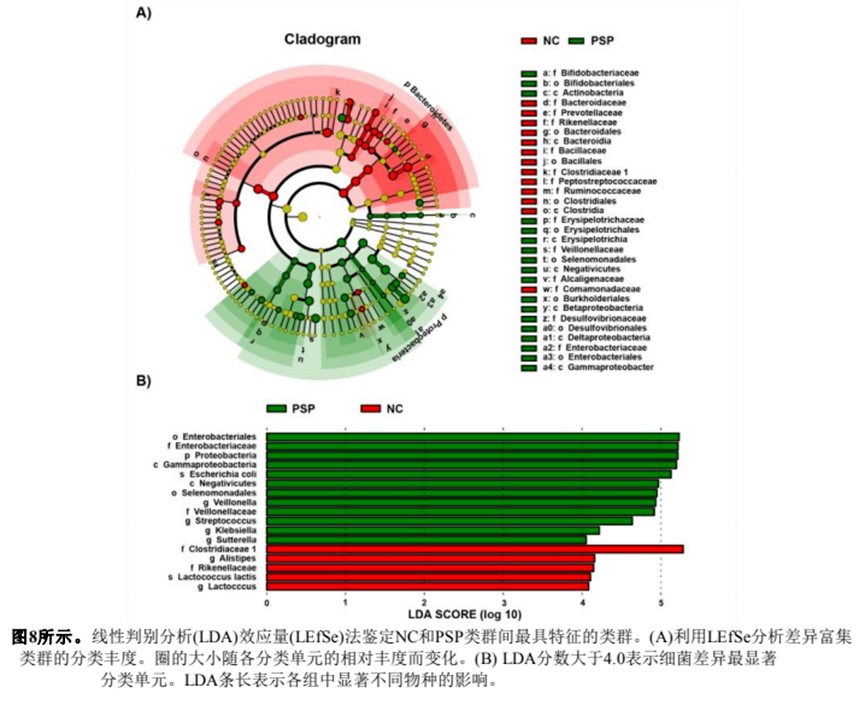
采用线性判别分析效应量(LEfSe)方法对各试验组的特定细菌分类群进行分析。如图8A所示,PSP中的主要细菌是Proteobacteria分支,NC组中的特征细菌是Bacteroidetes,在碳水化合物的发酵中起着至关重要的作用。绘制LDA评分(log 10)直方图,分析两组优势菌。如图8B所示,对照组的优势菌为f_Clostridiaceae 1、g_Alistipes、f_Rikenellaceae和g_Lactococcus。PSP组优势菌群为o_Enterobacteriales、p_Proteobacteria、c_Gammaproteobacteria等13种。
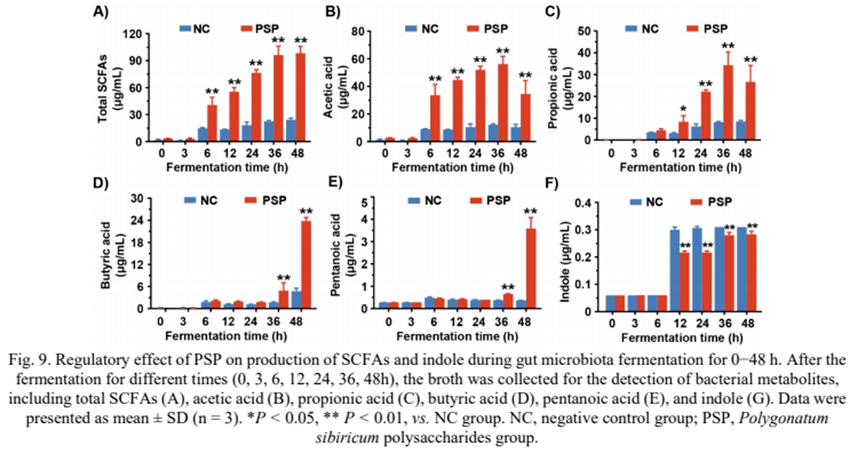
8) PSP对短链脂肪酸和吲哚生成的影响
由于短链脂肪酸和吲哚是摄入多糖后的主要细菌代谢物,我们在发酵48 h后检测了NC组和PSP组之间这两种代谢物的含量。如图9A所示,在发酵过程中,两组的总短链脂肪酸水平均有所升高。PSP组总短链脂肪酸浓度由0 h时的(3.32±0.14)μg/mL升高至48 h时的(98.21±5.51)μg/mL,显著高于NC组(P < 0.01)。结果表明,PSP促进了肠道菌群中短链脂肪酸的产生。
其中,36 h时,NC组乙酸浓度为(12.24±0.58)μg/mL, PSP组为(56.22±4.53)μg/mL(图9B)。发酵3 ~ 48 h期间,PSP组乙酸水平显著高于NC组(P < 0.01)(图9B)。PSP组丙酸浓度在36 h达到(34.36±4.92)μg/mL(图9C)。与上述两种短链脂肪酸不同,丁酸和戊酸主要在肠道菌群发酵后期产生(图9D和9E)。发酵48 h后,测定PSP组丁酸和戊酸含量分别为(23.82±0.67)μg/mL和(3.58±0.35)μg/mL。显著高于NC组(图9D和9E)。此外,我们通过GC-MS检测吲哚的含量。结果表明,NC组与PSP组在发酵初期(0 ~ 6 h)吲哚浓度无显著差异,但从发酵12 h开始,NC组的吲哚浓度高于PSP组(P < 0.01)(图9)。
9) PSP发酵液的抗氧化活性
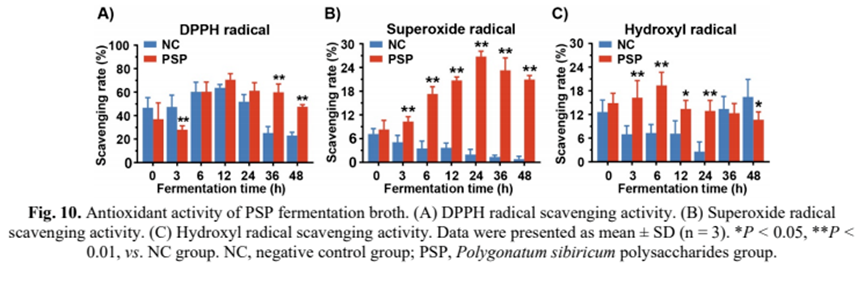
最后,我们考察了PSP发酵液对自由基的清除作用。与NC组相比,PSP发酵增强了肠道菌群对DPPH自由基的清除率(图10A),在12 h时清除率最高可达70.59%。另一方面,PSP组的超氧自由基清除率逐渐提高,在24 h时达到峰值(26.76%)(图10b)。总体而言,PSP组对超氧自由基的清除能力明显高于PSP组。有趣的是,在发酵过程中,NC对超氧自由基的清除能力呈下降趋势(图10B)。此外,PSP组对羟基自由基的清除效果比NC组要好(图10)。
3 结论
从黄精中分离得到分子量为3.06 kDa的果聚糖多糖。通过模拟消化和体外发酵的人体肠道菌群,我们证明了唾液、胃液和小肠消化液不能分解PSP。相比之下,肠道细菌显示出较高的PSP代谢活性。在PSP发酵过程中,肠道菌群的多样性和丰度受到显著影响,同时大量产生乙酸、丙酸、丁酸和戊酸等短链脂肪酸。此外,PSP发酵液还具有清除自由基的作用。我们的研究揭示了将PSP作为一种潜在的益生元应用于食品和制药工业。
上文引用:Food Science and Human Wellness
ISSN 2097-0765e-ISSN 2213-4530 CN 10-1750/TS
Editor-in-Chief: Bin Cong
https://www.sciopen.com/article/10.26599/FSHW.2022.9250184
版权:© 2024 北京食品科学研究院.